理科の動画「中和計算」を見ました。
中和するところを表やグラフから読み取ります。中和して出来る食塩と残る固体(水酸化ナトリウム)がどれくらいか、を求める問題ですが、考え方はどれも同じなので、しっかりと練習しましょう。

それでは始めましょう
動画を見る前にしておくこと
「科学の図鑑」と「科学の眼」を読んで、「クロスワードパズル」を解きましょう
◆基礎を固めたい場合◆
①デイリーステップ【2】~【6】を解きましょう
②デーマ【1】~【2】を読みましょう
③確認問題【6】【7】【8】を解きましょう
◆さらに挑戦したい場合◆
①発展【2】を解きましょう
構成
1.コアプラス・デイリーチェック
2.今回のポイント
3.確認問題(確認6,8,9)
4.発展問題(発展2)
5.今回のまとめ
6.学習のすすめ
1.コアプラステスト・デイリーチェック
コアプラス
(5)(6)てこの回転力です。支点を左端にして考えます。回転力を書いて考えましょう。(10)ばね秤の問題は、上向きのチカラを全部を出して考えましょう。ばねは上に80g、台はかりも上に90g、ですので、併せて、170gが重りの重さになります。
デイリーチェック
1⃣
地層です。小石、砂と積もっているので、海が深くなっていることが分かります。海が深くなったのは河口の位置が遠くなったとわかります。マグマは浸食を受けていないので、地上に出てからあとにマグマが出来た、と考えます。どの変化が一番新しいのか、などは、分かりましたか?
2⃣
等高線と地層の堆積物から考えます。レキの上端の深さを調べると、Aは6m、Bは10m、Cは6m、Dは10mとわかります。
2.今回のポイント
中和反応
中和は、化学変化の1つで酸性の水溶液とアルカリ性の水溶液を混ぜ合わせた時、たがいに打ち消し合う変化が起こること。中和により、塩(えん)と水ができる。
中和反応の「塩(えん)」は総称です。代表的な中和反応は覚えておきましょう。
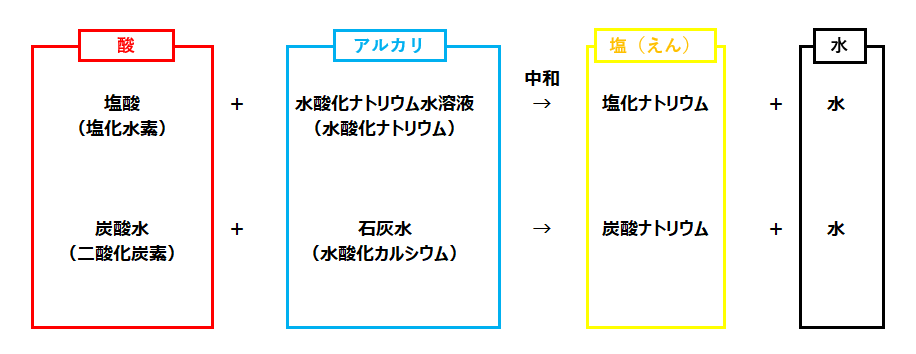
中和反応によ発生する熱を中和熱と呼びます。
中和計算
<代表的な問題です、解いてみましょう>
うすい塩酸(A液)100㎤と、うすい水酸化ナトリウム水溶液(B液)50㎤を混ぜてBTB液を加えると緑色になります。BTB液を加える前に水分を蒸発させると2.0gの固体が得られました。また、B液10㎤には0.3gの水酸化ナトリウムが溶けています。
(1)A液50㎤とB液50㎤を混ぜて水分を蒸発させると[ ]gの固体が得られます。
(2)A液80㎤とB液30㎤を混ぜて水分を蒸発させると[ ]gの固体が得られます。
<解説>
(1)塩酸100と水酸化ナトリウム水溶液50と食塩2.0、の関係です。塩酸50と水酸化ナトリウム水溶液50とすると、少ない方に合わせるので、食塩1.0、がでます。水酸化ナトリウム水溶液25は余っています。つまり、0.75gの水酸化ナトリウムが余っていますので、これを足して、1.75gの固体が出ます。
(2)塩酸80と水酸化ナトリウム水溶液30だと、少ない方がに合わせるので、食塩は1.2となります。水酸化ナトリウム水溶液は余っていないので、固体は、食塩のみとなります。
3.確認問題(確認6,8、9)
確認【6】
一定量の塩酸に、水酸化ナトリウムを増やして加えていく問題です。余るのが水酸化ナトリウムなので、蒸発させたときの固体が増えていきます、グラフの曲がり角に気付きましょう。少ない方に合わせます。固体として残るのは食塩と水酸化ナトリウムです。
確認【8】
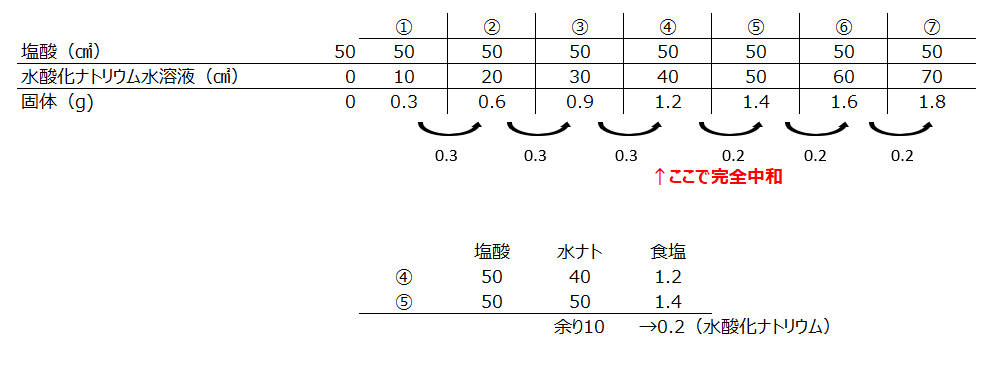
一定量の水酸化ナトリウム水溶液に、塩酸を増やし加えていくパターンです。この場合は、中和反応でできる食塩が固体です、が、余る塩酸は気体が溶けているので、蒸発しても固体が増えません。中和するところは、塩酸30㎤と水酸化ナトリウム50㎤の時です。
縦軸が固体の場合は、最初は2.4gから始まり、3.2gから横ばいになります。
縦軸が食塩の場合は、最初は0gです。中和した時の食塩の量は3.2gです
縦軸が水酸化ナトリウムの場合は、最初は2.0gです、最後に塩酸が30gの時に水酸化ナトリウムは0gになります。
自信が無い人は動画で確認して見ましょう。
確認【9】
条件が表ではなく、グラフで示されています。折れ曲がる箇所は1つですので、2つ曲がった時点で変だ、と気づきましょう、延長線の交点が中和点ですね。(4)塩酸45㎤、水酸化ナトリウム水溶液50㎤の時、食塩4.8gで中和します。水酸化ナトリウム水溶液50㎤のなかに3.0g入っています。塩酸90㎤、水酸化ナトリウム水溶液120㎤、を混ぜると少ない方は塩酸ですので塩酸2倍に合わせると、食塩は9.6gできます。水酸化ナトリウム水溶液が20g余るので、その中には水酸化ナトリウム1.2g含まれています。
4.発展問題(発展2)
発展【2】
一定量の塩酸に、水酸化ナトリウム水溶液を加えていきます。固体の増加量が変わる部分を見つけます、水酸化ナトリウム水溶液60㎤と80㎤の間が0.5g増加し、それ以降は0.4gずつ増えていくので、中和する量が表からは分かりません。単位量当たりにできる固体量を求めておけば、ここから、つるかめ算を使いますね。なかなか難しい問題ですね、動画では丁寧な説明があるので、確認してみましょう。
5.今回のまとめ
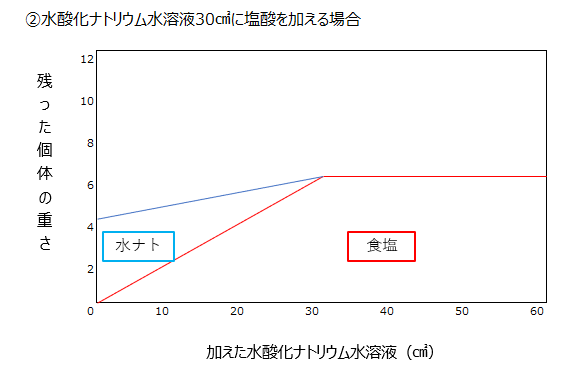
塩酸を加え続けていくのか、水酸化ナトリウム水溶液を加え続けていくのか、なにが生成されて、何が余っていくのか、を下記グラフで理解しましょう。
水酸化ナトリウムを加え続けると初めは食塩だけ固体として残りますが、中和後は、食塩と水酸化ナトリウムがのこり、加えた分だけ固体量は増えていきます。
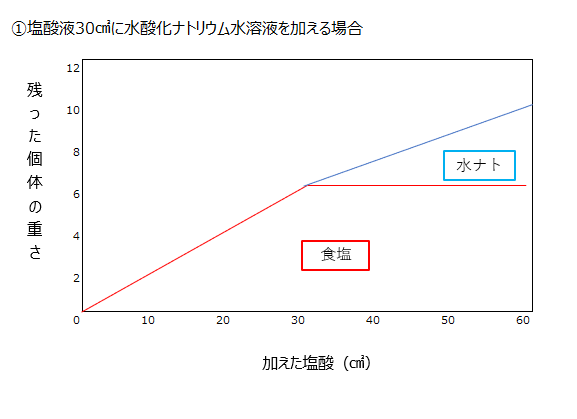
塩酸を加え続けると、中和するまでは食塩と水酸化ナトリウムが固体として残りますが、中和後は固体は食塩だけです。
自信のない人は動画で確認してみましょう。
6.学習のすすめ
♦基礎を固めたい場合♦
①デイリーステップ【1】を解いてデイリーチェックの複数を行いましょう。
②確認問題【1】【2】【3】【4】【5】【7】【11】を解きましょう
③ポイントチェックを解きましょう。
◆挑戦したい場合♦
①デイリーステップ【1】を解いてデイリーチェックの複数を行いましょう。
②確認問題【1】【2】【7】【10】【11】【12】を解きましょう
③発展【1】【4】【5】を解きましょう。
④ポイントチェックを解きましょう。
⑤コアプラスと理科資料の関連項目を見ましょう。
まとめ
中和反応は塩酸か水酸化ナトリウム水溶液のどっちが何が余るか、をしっかり理解しましょう。少ない方に合わせて考えます。問題文と表とグラフをしっかり読みとれるように練習しましょう。
最後まで読んで頂きありがとうございました。
下記に他の動画解説のページもありますので、紹介させてください。
参考になるとうれしいです。




コメント