理科の動画「化学計算総合②」を見ました。
グラフや表をうまく読み取って、比を用いて解いていく、のが前回と同じく問題として出題されています。とはいえ、大きくは変わらないので、まずは表に書き込んだり、とわかることから解き進めていきましょう。

そろそろ12月です、まだまだ基本確認しててもよいはずですよね?!
〜基礎編〜
コアプラスの解説
実験器具、環境問題の再徹底です。
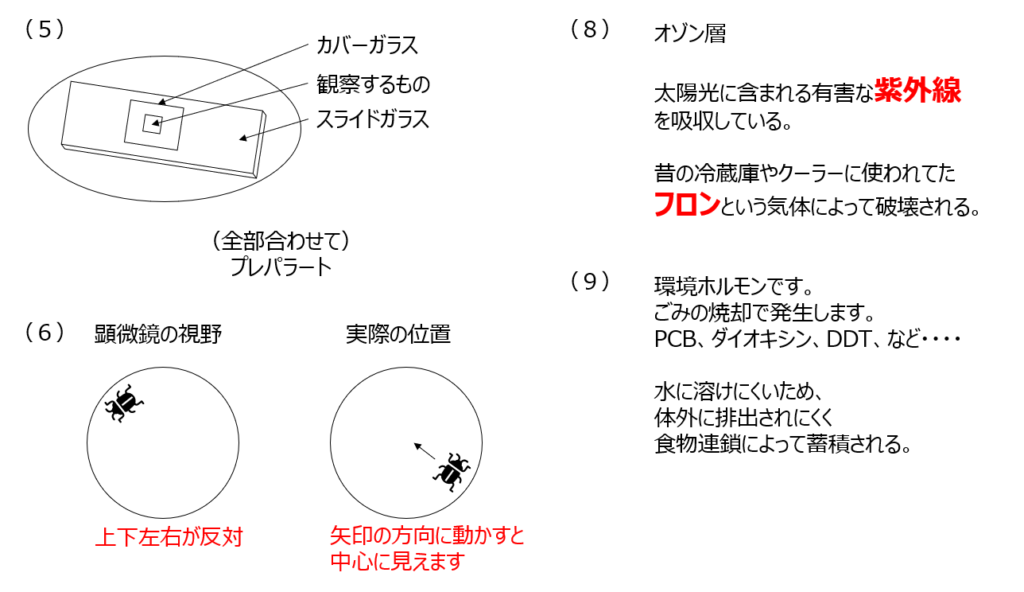
倍率の高い接眼レンズは短い方、対物レンズは長い方、です。スライドガラスの上に観察するものを載せて、カバーガラスを載せるたものがプレパラートです。顕微鏡の視野は上下左右が逆になります。顕微鏡は倒立の実像を見ています。
環境問題です、陸地は北半球の方が大きいですので、植物も多いです。
オゾン層は太陽光に含まれる有害な紫外線を吸収しています。可視光線の外側にあるのが紫外線です。昔の冷蔵庫やクーラーに使っていたフロンという気体によって破壊されます。オゾン層が薄いところをオゾンホールといいます。PCB、ダイオキシン、DDTはミスに溶けにくいため、体外に排出されにくく、食物連鎖によって蓄積されます。生物濃縮が問題です。
デイリーチェックの解説
1⃣
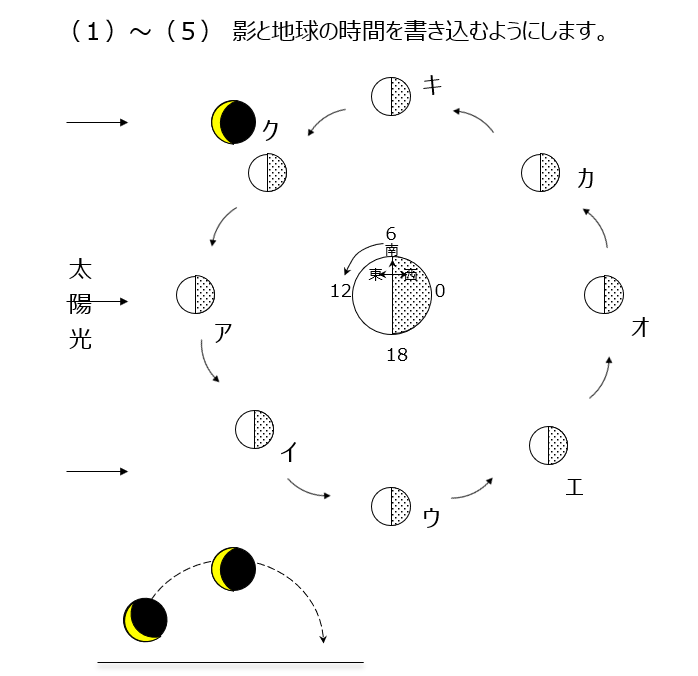
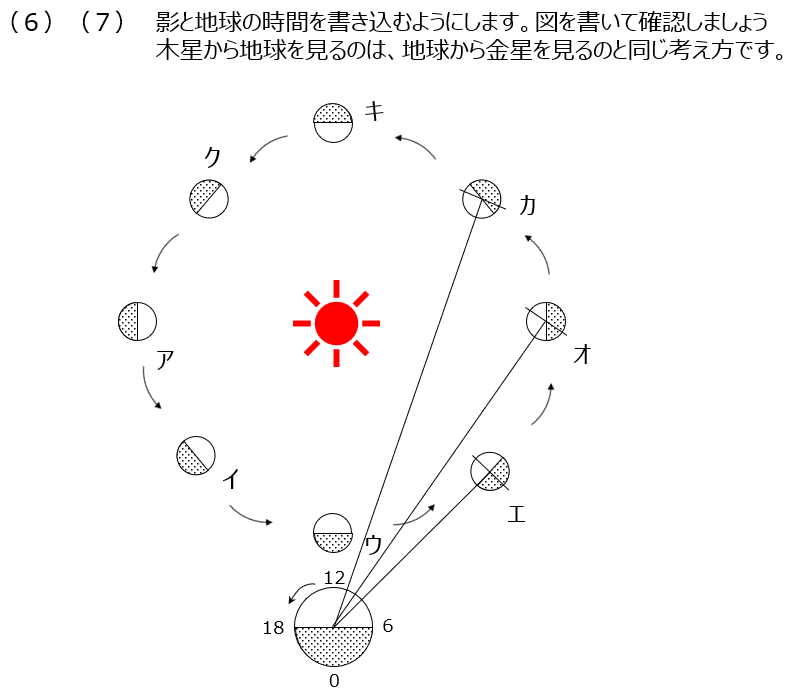
公転の問題です。太陽光が当たっている月の部分を考えましょう。金星の満ち欠けもきちんと理解しましょう。明けの明星、よいの明星の位置関係を確認します。木星から地球を見る場合は、地球は内惑星になります。
2⃣
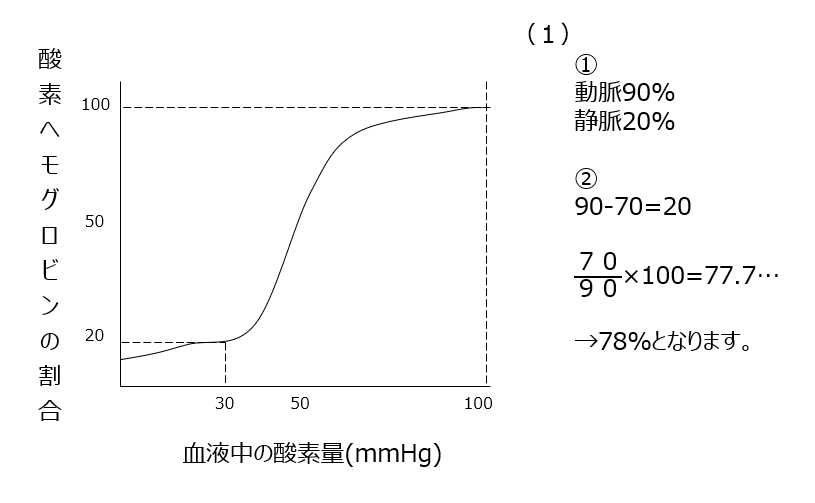
生物実験の問題です。酸素ヘモグロビンと血液中の酸素量の問題です。グラフから読み取れれば簡単な問題なので正解したいですね。
確認問題の解説
確認【1】
溶解度の問題です。表からしっかり読み取りましょう。何℃の何グラムの水にどれくらい解けるか、を読み取ります。水100gに換算して考えるようにするのがコツですね。
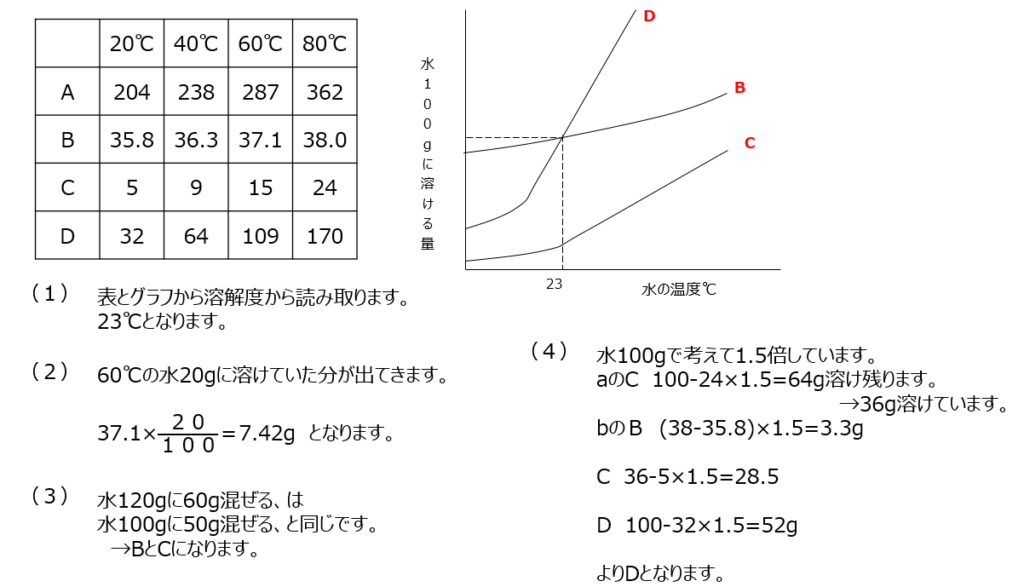
確認【2】
硝酸カリウムの溶解度の問題です。(1)水の量を100gに換算して考えます。(2)飽和水溶液の濃度を求めます。小数点の位置について気を付けましょう。(3)間違えやすい問題ですが、しっかり取り組みましょう。水溶液200gの中に、水と硝酸カリウムがそれぞれ何gあるか、を考えます。飽和水溶液が200gですよ。

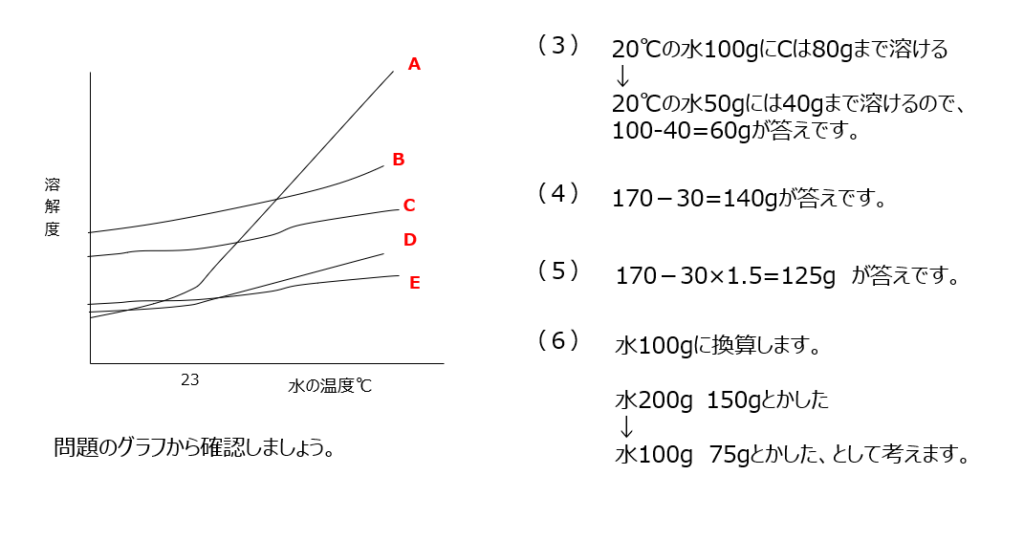
確認【3】
グラフの読み取りを中心に解く溶解度の問題です。再結晶、です。溶け残り量をグラフと水の量から求めます。(6)でも水100g換算での計算が有効ですね。
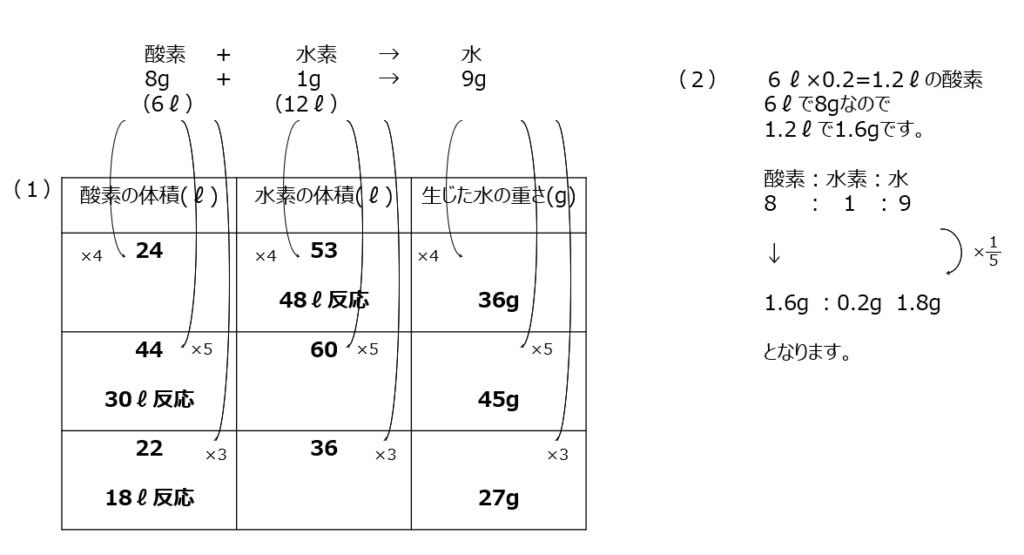
確認【4】
水素と酸素の化学反応で水ができる問題です。質量保存の法則ですね。割合の計算を用いて解きます。
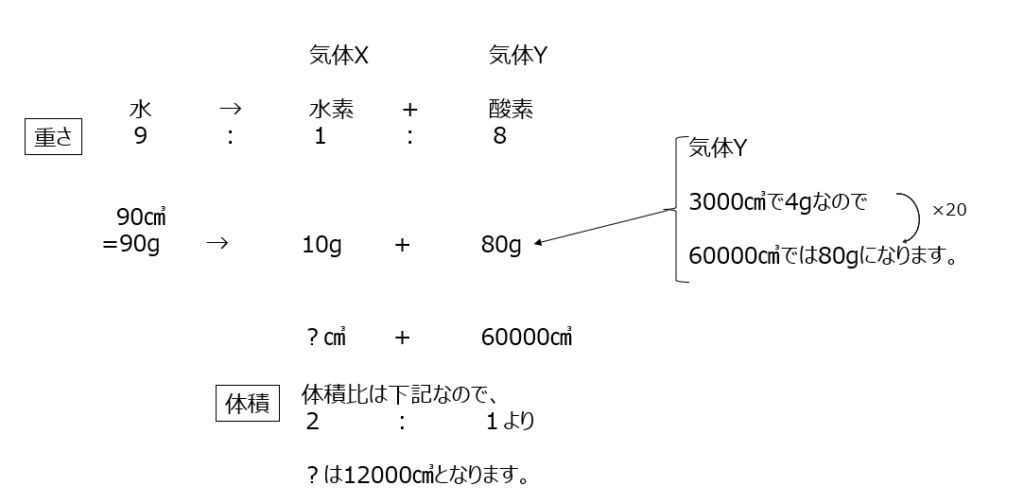
確認【5】
水に電気を通して、水を水素と酸素に分解させる問題です。気体Xが水素で、気体Yが酸素ですね。重さの比ですね。体積と重さの変換を間違わないようにしましょう。
〜標準編〜
確認問題の解説
確認【6】
炭酸水素ナトリウム(重曹)です、加熱する問題です。試験管にいれます。炭酸水素ナトリウムは白い固体で水にとけると弱いアルカリ性になります。炭酸水素ナトリウムは、加熱によって、炭酸ナトリウムと水と二酸化炭素になります。炭酸ナトリウムは白い固体で水に溶けると強いアルカリ性を示します。二酸化炭素は石灰水を白く濁らせます。水は加熱部に流れると急に冷えて割れる恐れがあるので、試験管の口を下げておく必要があります。分解、と言います。
塩酸と炭酸水素ナトリウムが完全反応した量を求めた考えましょう。
確認【7】
phが出てきます。7より小さいと酸性、7より大きいとアルカリ性、7が中性です。酸性をいくら薄めても、アルカリ性にはならないので、7にしかなりません。アルカリ性はぬるぬるします、皮膚をすこし溶かしているからです。
確認【8】
アルミニウムと薄い塩酸を反応させます。過不足なく反応しているところを探しましょう。3つの物質の2つの関係しかわからない様な問題です。これを3つの関係に整えていきます。水素量をそろえて考えます。その後にX液とY液をそろえます。
確認【9】
水酸化ナトリウム水溶液と塩酸、アルミニウムの問題です。表に数値を書き込んで整理しながら解いていくようにしましょう。④の中和反応の量から、それぞれの余る量を表に記載してみましょう。アルミニウムが不足していることも考慮しましょう。中和反応時の中和熱の大きさは、中和した量に注目します。固体として何が残るかも理解しておきましょう。
〜発展編〜
発展問題の解説
発展【1】
青色と白色の硫酸銅の問題です。比を使って解きます。(3)では白色の硫酸銅が反応後に余った水の量を出して考えましょう。余った水の量を使って反応した青色の硫酸銅の量を出して解き進めます。
発展【5】
塩化水素と水酸化ナトリウムの問題です。質量保存の法則には気付きましょう。水酸化ナトリウムが余るときの計算はつるかめ算を使うことになりますね。
まとめ
化学計算は慣れもあるでしょうけど、算数のように比を用いて解いていきます。ただ、理科の場合は割り切れない、など計算の手間が発生しますが、根気く計算しましょう!!
最後まで読んで頂きありがとうございました。
下記に他の動画解説のページもありますので、紹介させてください。
参考になるとうれしいです。




コメント